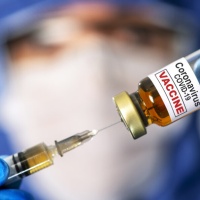
Câmara dos Deputados aprovou MP com prazo de cinco dias para Anvisa autorizar vacina registrada fora do país
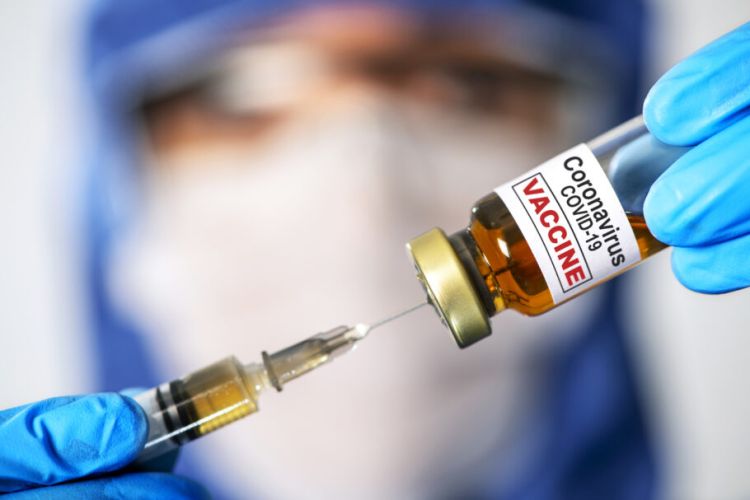
A Câmara dos Deputados aprovou nesta sexta-feira (18) o texto-base da medida provisória que trata da compra e distribuição de vacinas contra a Covid-19 no Brasil. De acordo com matéria publicada pela G1, a proposta fixa prazo de até cinco dias para a Agência Nacional de Vigilância Sanitária (Anvisa) autorizar o uso emergencial do imunizante aprovado em pelo menos uma de oito autoridades estrangeiras listadas.
Para concluir a votação, os parlamentares ainda precisam analisar destaques, que são sugestões para alterar o texto. Depois, a matéria ainda terá que ser discutida no Senado. Inicialmente, a MP foi editada pelo Executivo para garantir a participação do Brasil na Covax Facility, programa coordenado pela Organização Mundial da Saúde (OMS) para impulsionar o desenvolvimento e garantir a compra de vacinas contra o novo coronavírus.
O texto aprovado pelos deputados não traz a exigência de que os vacinados assinem um termo de responsabilidade. O relator chegou a cogitar incluir isso a pedido do governo, mas acabou voltando atrás. O projeto diz que o governo, por intermédio do Ministério da Saúde, deve comprar e distribuir as vacinas registradas pela Anvisa, com preferência para as que sejam produzidas no Brasil, por empresa brasileira sediada no estrangeiro ou por empresas que invistam em pesquisa e no desenvolvimento de tecnologia no País.
O Ministério da Saúde vai coordenar o programa de imunização e, caso haja omissão ou irregularidades nesse processo, os estados ficam autorizados a adotarem medidas necessárias para imunizar suas respectivas populações, “cabendo à União a responsabilidade por todas as despesas incorridas para essa finalidade”. A MP também permite que o governo celebre contratos para comprar insumos e vacinas, antes mesmo do registro sanitário ou da autorização temporária para uso emergencial dos produtos.
A MP estabelece prazo de cinco dias para que a Anvisa conceda autorização temporária de uso emergencial para importação, distribuição e uso de qualquer vacina contra o coronavírus, contados a partir da formalização do pedido. A autorização temporária só poderá ser feita com relação a vacinas já aprovadas por pelo menos uma das autoridades sanitárias. Sendo que uma lei aprovada em maio pelo Congresso estabelece um prazo de 72 horas para que agência brasileira autorize, de forma excepcional e temporária, a importação e a distribuição de medicamentos e insumos para o combate à Covid-19 registrados na autoridade de um desses países – Estados Unidos, Japão, China ou na agência da União Europeia.
Fonte: G1
#covid19 #vacina #anvisa #textoaprovado #câmaradosdeputados #textobase #medidaprovisória #compraedistribuição